中國的藥品專利糾紛早期解決機制,指的是銜接藥品上市審批程序與藥品專利糾紛解決程序的制度。2020年10月,在新修正的中國《專利法》第76條中,引入藥品專利糾紛早期解決的相關規定,明確由國務院藥品監督管理部門和國務院專利行政部門制定藥品上市許可審批,與藥品上市許可申請階段專利糾紛解決的具體辦法。
而在2021年7月4日,中國國家藥品監督管理局和國家知識產權局聯合發佈了《藥品專利糾紛早期解決機制實施辦法(試行)》,對於首個挑戰專利成功並首個獲批上市的化學仿製藥,給予12個月市場獨占期,並自發佈之日開始施行。
圖片來源:Pixabay
藥品專利糾紛早期解決的途徑
根據《藥品專利糾紛早期解決機制實施辦法(試行)》規定,專利權人或者利害關係人若對四類專利聲明有異議,可以就申請上市藥品的相關技術方案是否落入相關專利權保護範圍,向人民法院提起訴訟,或是向國務院專利行政部門請求行政裁決。在規定的期限內,專利權人可以自行選擇司法途徑或行政途徑。如果當事人選擇向國務院專利行政部門請求行政裁決,對行政裁決不服又向人民法院提起行政訴訟的,並不會延長等待期。若專利權人或者利害關係人未在規定期限內提起訴訟或請求行政裁決,仿製藥申請人可以按相關規定提起訴訟或者請求行政裁決,以確認其相關藥品技術方案不落入相關專利權保護範圍。
圖一、藥品專利連結中的四類聲明

圖片來源:2021/11/15,「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報資料
中國藥品專利連結的相關規定在《專利法》第76條。藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關係人,因申請註冊的藥品相關的專利權產生糾紛的,相關當事人可以向人民法院起訴,請求就申請註冊的藥品相關技術方案是否落入他人藥品專利權保護範圍作出判決。國務院藥品監督管理部門在規定的期限內,可以根據人民法院生效裁判,作出是否暫停批准相關藥品上市的決定。藥品上市許可申請人與有關專利權人或者利害關係人也可以就申請註冊的藥品相關的專利權糾紛,向國務院專利行政部門請求行政裁決。
圖二、中國藥品專利連結制度運行機制
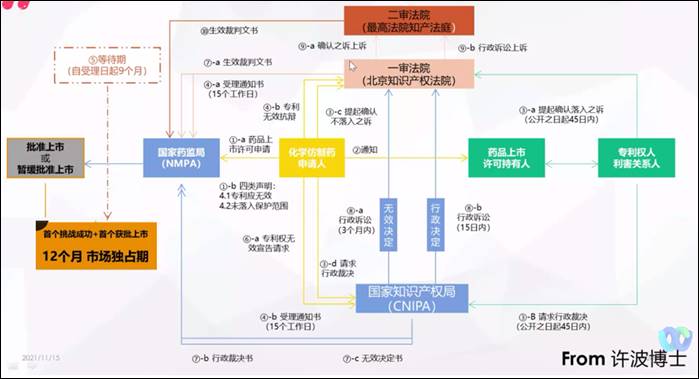
圖片來源:2021/11/15,「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報資料
知元同創知識產權代理事務所執行合夥人劉元霞解釋,對權利人而言,《專利法》第76條的好處在於可以選擇雙途徑救濟,且以法院優先,即便已求助行政途徑,也可以在法院立案。在實施辦法落地後,也確認了只有權利人可以先啟動程序,仿製藥企業在發起聲明後需要等待45天,而原研藥企業則一定會將45天的權利用盡。
仿製藥專利申請人挑戰首仿藥
根據試行辦法第11條,對首個挑戰專利成功並首個獲批上市的化學仿製藥,將給予市場獨占期。國務院藥品監督管理部門在該藥品獲批之日起12個月內,不再批准同品種仿製藥上市(共同挑戰專利成功的除外);市場獨占期以不超過被挑戰藥品的原專利期為限。市場獨占期內,國家藥品審評機構不停止技術審查。劉元霞表示,挑戰專利成功是指化學仿製藥申請人提交四類聲明,且根據其提出的宣告專利權無效請求,相關專利權被宣告無效,因而仿製藥可獲批上市。這裡涉及對四類聲明的理解:4.1類認為落入但無效,4.2類認為不落入,無論是做了4.1類聲明或是4.2類聲明,都可以發起專利無效的挑戰。因此,仿製藥申請人若能提交四類聲明,且發起專利無效挑戰,一但專利被宣告無效,就可能獲得首家挑戰成功的機會。
劉元霞認為,登記平台中相關專利有產品、組合物和用途等類型,但一般的仿製藥僅落入其中一項或兩項專利,可以僅針對有落入風險的專利發起挑戰,避免提起過多訴訟程序,有利於仿製藥申請人及早解決糾紛。
中國專利連結相關專利類型,分為化合物、組合物和用途;非專利連結相關專利類型則有晶型、製備方法和檢測方法。劉元霞統計近五年來的中國藥品專利的無效案件,涵蓋化合物、製劑、用途、晶型四種類型,同一個專利只限統計一次,而且以最終的決定為准;部分無效的專利只要核心產品能夠保留,就歸為未無效之列。雖然資料可能有遺漏,但可參考整體趨勢。從全部無效案件量觀察,「用途」是最難被無效的,其次是化合物、製劑,最後是晶型。其中,製劑整體無效的成功率為60%,但分析2021年的案件會發現,只有「製劑」的無效成功率是不減反升的。
圖三、中國藥品專利無效成功率
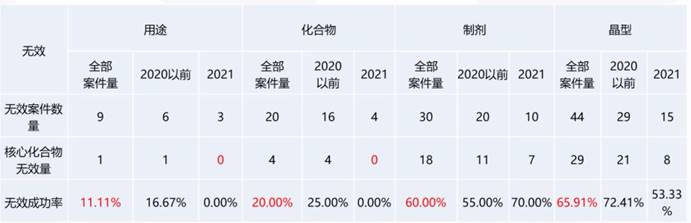
圖片來源:2021/11/15,「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報資料
藥品專利保護期補償制度
專利期延長制度(patent term extension,簡稱PTE),指的是藥品專利保護期補償,申請主體為專利權人,條件是中國獲批上市的新藥發明專利。根據中國《專利法》42條規定,專利補償期限一般不超過五年,新藥上市後總有效專利權期限不超過十四年。
圖四、中國專利補償期限
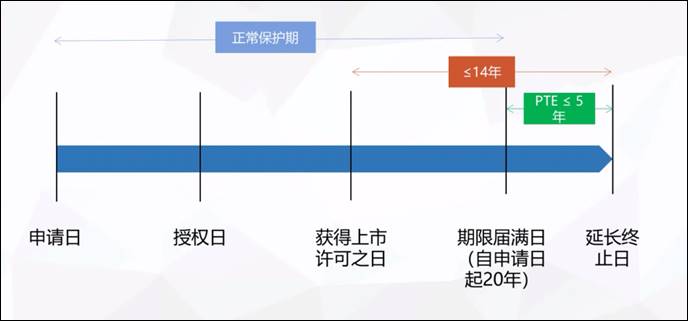
圖片來源:2021/11/15,「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報資料
中國國務院藥品監督管理部門負責批准上市的創新藥和符合規定的改良型新藥,對於藥物活性物質的產品專利、製備方法專利或者醫藥用途專利,可以給予藥品專利期限補償。而請求藥品專利期限補償,應滿足以下條件:
(1)請求補償的專利授權公告日應當早於藥品上市許可申請獲得批准之日;
(2)提出補償請求時,該專利權處於有效狀態;
(3)該專利尚未獲得過藥品專利期限補償;
(4)獲得上市許可的新藥相關技術方案應當落入請求補償的專利權利要求的保護範圍;
(5)一個藥品同時存在多項專利的,只能請求對其中一項專利給予藥品專利期限補償;
(6)一項專利同時涉及多個藥品的,只能對一個藥品就該專利提出藥品專利期限補償請求。
劉元霞指出,大部分專利權利人比較關心的是專利期限的問題,若是一個藥品同時存在多項專利,一般會選擇保護期最長的。
PTE延長的審批流程
根據審查指南(徵求意見稿)規定,專利權人請求藥品專利補償,應當自藥品上市許可申請獲得批准之日起,三個月內向專利局提出請求,並繳納相應費用。專利局可對符合條件的藥品專利給予藥品期限補償,以彌補在專利有效期內,該新藥上市審批所占用的時間。藥品專利補償期限的計算方式為:藥品上市許可申請獲得批准之日減去專利申請日,再減去五年所得的時間。劉元霞指出,該補償期限不超過五年,且該藥品上市許可申請批准後總有效專利權期限不超過14年。這種計算方式可謂是有些簡單粗暴,計算得到的補償期限與企業實際想要獲得的期限相比更短。此外,中國對PTE延長的審批流程規定得不明確,或許未來能參考美國PTE相關程序,對延長期的審批流程做出更細緻的規定。
如何進行專利聲明
化學仿製藥申請人、中藥同名同方藥申請人、生物類似藥申請人提交藥品上市許可申請時,應當對照已在中國上市藥品專利資訊登記平台公開的專利資訊,針對被仿製藥每一件相關的藥品專利作出聲明。仿製藥申請被受理後10個工作日內,仿製藥申請人應當將相應聲明及聲明依據通知上市許可持有人。其中,聲明未落入相關專利權保護範圍的,聲明依據應包括仿製藥技術方案,與相關專利的權利要求對比表,以及相關技術等資料。
圖五、中國上市藥品專利登記資訊平台示意圖
圖片來源:2021/11/15,「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報資料
截止至2021年11月14日,共有919條專利信息登記資訊,其中有612條做出專利聲明。而做出專利聲明中,共有12個四類聲明,其中只有5個品種、共6項專利,做出了4.1類聲明。
圖六、中國上市藥品專利資訊登記平台 — 專利資訊公示和專利聲明
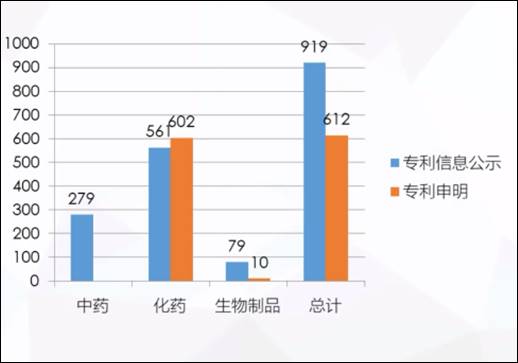
圖片來源:2021/11/15,「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報資料
首仿藥專利挑戰策略
劉元霞提醒,若想成為首仿藥,可以關注中國專利資訊登記平台上的登記資訊,因為權利人或利害關係人會就相關產品的狀態,在登記平台上及時更正。一旦申報資訊公開,為盡可能爭取到首仿,無效請求也會在第一時間提出。所以,同品種的其他企業關注到該資訊後,能夠大致判斷公司在該品種上的競爭力,以及是否有首仿機會。值得注意的是,首家申報的企業並非就會首家獲批,因此,第二至第五家申報的企業仍然有機會獲得首家獲批的資格。
另外,專利權利人請求藥品專利期限補償,應從藥品上市許可獲得批准之日起三個月內向專利局提出請求,因此關注PTE相關訊息,對仿製藥企業的影響是非常大的。
參考資料:
- 2021/11/15,專利師公會主辦「中國藥品專利糾紛早期解決機制下首仿藥專利挑戰策略」,劉元霞簡報
- 2021/7/4,中國國家藥監局、國家智慧財產權局關於發佈《藥品專利糾紛早期解決機制實施辦法(試行)》的公告(2021年第89號)
| 作者: |
吳碧娥 |
| 現任: |
北美智權報資深編輯 |
| 學歷: |
政治大學新聞研究所 |
| 經歷: |
驊訊電子總經理室特助
經濟日報財經組記者
東森購物總經理室經營企劃 |
|
|
|
| Facebook |
|
在北美智權報粉絲團上追踪我們 |
     |
|
|
|
|
|
|
|

