「現在中國要進口原料藥,不管是哪個國家,台灣、香港、澳門或其他國家都一律同等對待,第一點就是原料藥在當地市場生產國上市,拿到上市許可證以後,送到北京的 CFDA 去申請,來來回回大概四年。台灣的原料藥廠商過去很多年來,弄到最後就放棄了,因為耗費了四年多,當初的商機早就完全不見了,這樣來回耗資源,很多台灣原料藥廠可能都要關掉搬到大陸去了,我相信這一定不是大家願意見到的…」-- 神隆總經理馬海怡 |
|
以全球高齡化的趨勢,各國發展生技及生醫產業動作頻頻,台灣生醫產業在過去4年內市值成長了520%。台灣生技月於七月下旬登場,由財團法人生物技術開發中心(Development Center of Biotechnology, DCB)主辦,為兩岸生技與醫材產業的發展注入更多能量、並促進兩岸交流,7月19日於南港展覽館舉辦之「2013兩岸生醫產業合作高峰論壇」邀請兩岸製藥廠的代表一起暢談兩岸生技製藥的合作與未來,當中點出了廠商面臨的許多法規與認證之挑戰。
整體缺乏創新 資源無法共享
大陸國務院規劃2013年至2015年之間,生物產業產值每年平均成長將逾20%。以此數值進行推估,大陸生物產業(生技)相關產值可望倍增至4兆元人民幣。同時,大陸也亟欲透過生物產業,解決能源問題。因此,在「2013兩岸生醫產業合作高峰論壇」中,「大陸生物技術產業十二五發展規劃」成為關注焦點。
論壇中,中國生物技術發展中心處長邱宏偉就「大陸生物技術產業十二五發展規劃」議題,說明全球經濟在2008年之後便發展緩慢,生物產業卻發展蓬勃,大陸去年更高於整體產業發展的20%。然而產業的發展缺乏創新,雖然在大陸內地建了不少生醫發展平台,可是資源共享的能力及平台利用率都太低,以致形成資源浪費。邱宏偉從三個面向提出建議:1. 整體佈署。生物技術應用面比較廣,在醫藥、農業、能源、環保、材料等需要很長期的發展和共同兼顧,怡長時間佈署與推廣。2. 突出創新產業。要有自我創新的能力,引進外部技術後,吸收再創新。3. 點面結合發展。從觀念技術的點來學習,以點進行全面發展,來推動生物產業技術。邱宏偉也期許中國的生物技術的創新能力要全面提昇,去年2012年生技產業在中國佔 GDP的4.6%,預計在2015年十二五結束的時候,能提高到 GDP 的6%。
台灣製藥優良品質 中國產銷優勢互補
製藥業在歐美成長已趨緩,在新興市場則爆發力正強。財團法人生物技術開發中心副執行長鄭建新以「兩岸生醫產業合作進展與未來展望」為題,說明新興市場是生技製藥產業的成長關鍵。中國在2011年製藥產值就達到 667億美元的市場規模,目前是全球第三大的藥品市場,但依照成長的趨勢,在2016年中國會取代日本成為全球第二大的藥品市場。鄭建新認為,大陸要創造差異化的產品,藥品的市場是和生活水平息息相關,應該開發藥品來適應各種族群、符合市場需求。今年年初,台灣領先中國、日本及韓國,已正式成為「國際醫藥品稽查協約組織」(PIC/S)第43個會員,大幅提升國內藥廠製造藥品的品質,過去台灣藥品外銷,需耗費多年來通過國外考核,現成為PIC/S會員後,東協十國、馬來西亞、新加坡、澳洲、瑞典、瑞士、加拿大等國家皆採認我國對於藥品GMP之查核結果,不但可免去重複查廠時間,更可減少成本、競爭力也較以往強勁。
依據生物技術開發中心預估,台灣 2013年的原料藥成長率可望達到 23.2%(表一),因此「大陸市場可以借鏡台灣在管理訓練製造的經驗來提昇產業水準,而台灣是亞洲第一個通過 PIC/S的國家,台灣非常注重品質專業,兩岸可以由產業鏈來進行合作與互補。」鄭建新建議兩岸法規應儘快相互認證、提供醫藥品快速審查管道,希望相互認可、並縮短藥品上市時程。
表一、製藥產業產值預估
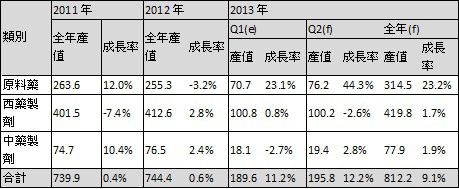
註:成長率係指年增率;(e)為推估值;(f)為預測值
資料來源:生物技術開發中心產業資訊組ITIS計畫預估整理
簡化文件作業 加速兩岸藥品認證
在「兩岸生技製藥產業商機與展望」議題中,與談人包括東洋董事長林榮錦、廈門特寶生物工程公司總經理孫黎、台灣神隆公司總經理馬海怡、康聯藥業執行長李欣、健亞生技總經理陳正、石藥集團董事長蔡東晨、中天生技董事長林衛理,均就兩岸的製藥合作暢談經驗。當中神隆總經理馬海怡說明神隆目前的營業額百分之百的是賣原料藥至歐、美、日等地,現在公司要往下游整合,原因在於客戶買了原料藥卻找不到廠商做針劑,因此在南科動土蓋場,新蓋得針劑廠預計兩年後可以開工。為了增加產能,神隆在大陸常熟也複製一樣的廠,藥廠完全符合新發布的大陸GMP要求。也希望能與大陸藥廠合作,與康聯藥業負責行銷業務,一起在大陸內地尋找 CMO 合作廠商,結合兩岸的力量一起合作發展,卻在發展過程中遇到了一些問題。
馬海怡首先指出和大陸合作最重要的商機在於台灣很多特殊的原料藥,大陸有很好的規格可以生產出來,照理說可以有很大的市場,但卻沒辦法很快的從台灣取得原料藥,原因在於大陸藥品法規限制繁瑣,耗時耗力。馬海怡進一步說明,「現在中國大陸要進口原料藥,不管是哪個國家,台灣、香港、澳門或其他國家都一律同等對待,第一點就是原料藥在當地市場生產國上市,拿到上市許可證以後,送到北京的 CFDA 去申請,來來回回大概四年。台灣的原料藥廠商過去很多年來,弄到最後就放棄了,因為耗費了四年多,當初的商機早就完全不見了,這樣來回耗資源,很多台灣原料藥廠可能都要關掉搬到大陸去了,我相信這一定不是大家願意見到的。」
關於認證過程的耗時耗力,馬海怡也呼籲兩岸應儘快提出因應之道。「台灣的衛生署非常瞭解,大陸的 CFDA也非常清楚這樣狀況,我們想尋求一種綠色通道或互相驗證的一種方式,卻總是求救無門。大陸衛生署曾跟我們說過這事根本沒有人敢拍板。台灣的原料藥廠商 99% 是外銷,因為台灣不用申請藥證,可是為了要進大陸,我們要花一年到一年半的時間申請台灣的藥證,拿到台灣藥證才可以申請大陸。而大陸的客戶急得要命,他們要搶 first file的生產批次,而神隆要循正常管道、不走私的進大陸市場,這扇門卻很難打開。」
儘管神隆在大陸已設廠,仍遭遇耗時耗力的難題,馬海怡為國內業者叫屈,「神隆當初因為產能不夠,所以選擇在中國常熟蓋廠。如果不管台灣生產的產品要不要進中國市場,就用大陸的廠申請、跑中國內地流程,就不用多一個進口的關卡,可是這長期來說是海峽兩岸的損失,因為大陸那邊非常需要原料藥,怎麼要才能找到一個互相認證的方式,對雙方才最有利?能不能用台灣的GMP藥證也當作大陸的藥證,或用什麼樣的方式去簡化,不要變成雙重的要求,簡單講就是 GMP 的互認。我們的品質保證,也歡迎大陸的 CFDA來查廠,台灣的原料藥廠用全世界最嚴格的標準來審查都能合格,兩邊加速認證以後,才能一起進攻歐美市場。」
中國藥品市場特色在於人口結構多元化的需求與商機亟待滿足,若能與當地通路商合作,則可快速拓點,唯法規規定繁瑣,成為生技醫藥發展的極大阻礙。台灣生技醫藥的優勢在於高品質的管理人才與技術;品質嚴格要求的產品與服務經驗可以整廠輸出,生產與技術都相當具有優勢。兩岸應生醫合作應從法規相互認證著手,採相互合作、互補的發展策略,並強化生醫智財權保護,再談市場行銷與通路布局,才有共創市場的可能。
更多歷期精采文章,請參閱智權報總覽 >>
|