目前新冠病毒已於全球多個國家肆虐,各國的疾病防控部門 、藥物研究機構都已針對國內外公開且進入臨床試驗或臨床前研究階段的各種藥物開展了廣泛的篩選試驗工作,希望可以以最短的時間找出及產出高效的抗新冠肺炎藥物。像中研院便在極短的時間內成功合成高純度的「瑞德西韋」。當然,疫情最嚴重的中國在這方面更是積極。值得一提的是,中國不管在發展什麼「產業」,智財專利一定先行。像這次為了支援抗新冠肺炎藥物的研發,中國國家知識產權局「抗擊新型冠狀病毒肺炎專利資訊分析課題組」於2月14日即發表了《抗擊新型冠狀病毒肺炎專利信息研報》,內容鉅細靡遺,看來除了為科研人員技術攻關提供資料支撐外,其完善專利布局的企圖也不容忽視。

圖片來源 : shutterstock、達志影像
這次國知局的報告以中國國家衛健委發佈的《新型冠狀病毒感染的肺炎診療方案(試行第五版)》為主線,對治療用藥、預防用藥和病毒檢測三個關鍵分支的專利資訊進行全面梳理,從化學藥、生物藥、疫苗、檢測方法和檢測儀器五個方面展開論述。此報告之專利數據來自德溫特世界專利索引資料庫(DWPI)、中國專利文摘資料庫(CNABS)、中國藥物專利資料庫(CNMED)、CAPlus 資料庫及抗擊新型冠狀病毒肺炎專利資訊共用平台,檢索截止時間為 2020 年 2 月 9 日。在篩選出中外專利關鍵技術資訊 7000 多項後,再通過人工閱讀篩選出專利分析樣本。
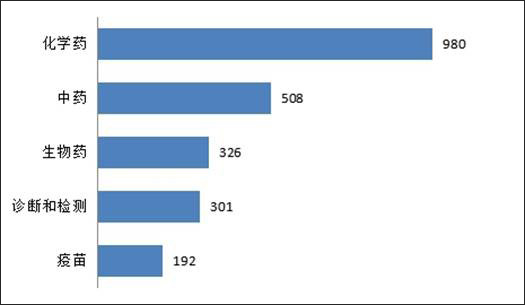
報告統計發現,在抗病毒產業鏈中,化學藥一類專利申請數量最多,其980件,其次為中藥類508件,生物藥類326件,診斷和檢測301件,疫苗 192 件;如圖1所示:
圖1. 病毒產業鏈中5種分類的專利數
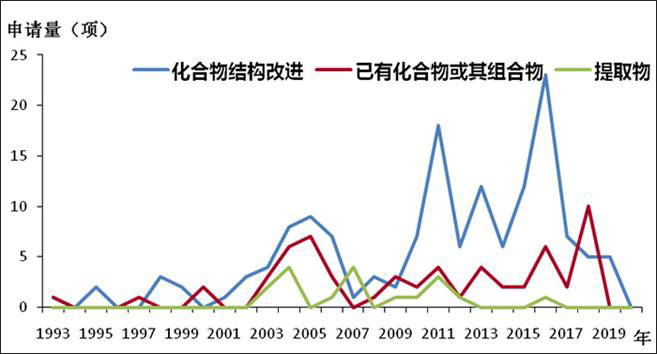
報告指出,從趨勢上看,抑制冠狀病毒活性的化學藥專利申請量與2003年SARS,2009年甲型H1N1流感疫情、2012年中東暴發MERS疫情、2015年韓國暴發MERS疫情呈正相關。開發已有化合物或其組合在抑制冠狀病毒方面用途占26.7%,即「老藥新用」這一創新思路貫穿於整個技術發展過程中。
抗冠狀病毒感染活性化合物專利申請總體情況
圖2. 抗冠狀病毒感染活性化合物申請類型與趨勢
因此,報告對於治療藥物之重點為對上市藥新適應症、已進入臨床試驗的在研藥以及體外試驗證明有效的在研藥進行研判,從RNA阻斷、囊膜阻斷的兩大方向著墨,並對7種老藥新適應症,3種臨床試驗在研藥,像是瑞德西韋、匹莫地韋,和多種對冠狀病毒有明顯抑制作用的在研藥在專利資訊中披露出的資料進行篩選。
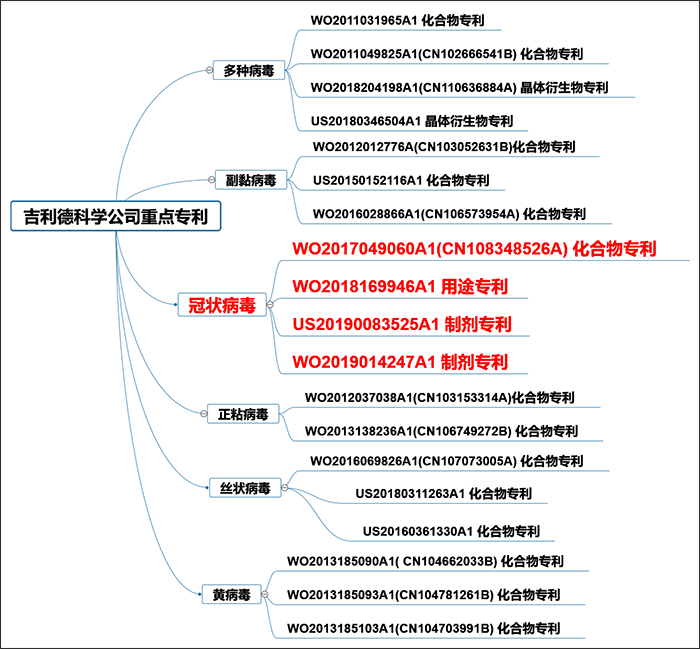
吉利德科學公司 (Gilead Sciences International Ltd) 是此領域的主要專利申請人,重點研究領域包括人類免疫缺陷病毒(HIV)/愛滋病,肝臟疾病。代表產品包括:替諾福韋(抗乙型肝炎病毒)、阿德福韋酯和富馬酸替諾福韋酯(抗HIV感染)、索非布韋(抗丙肝病毒)。在抗病毒研究方面具有較為豐富的經驗。如圖5所示,吉利德在抗RNA病毒領域,圍繞核苷類RNA聚合酶抑制劑進行了專利佈局,並特別注意到了對於冠狀病毒感染的治療作用。
圖3. 抗冠狀病毒化學藥技術分解表
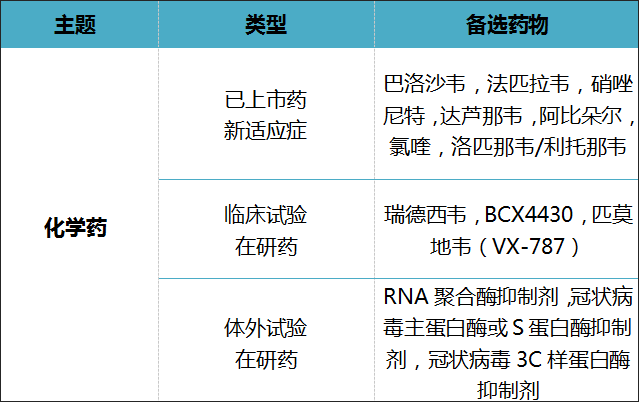
圖4. 與冠狀病毒相關的上市藥專利資訊
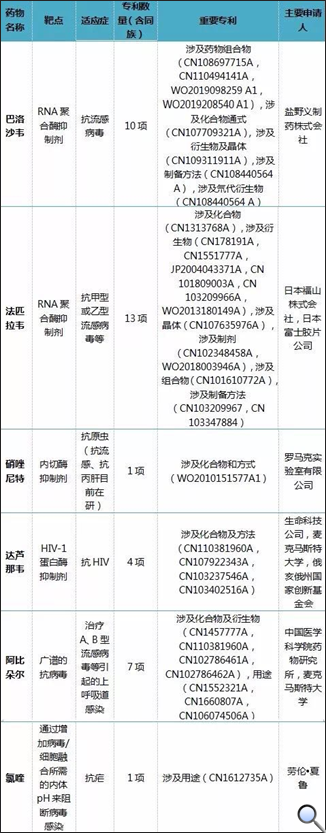
針對臨床試驗在研藥,報告除了對目前被寄予厚望的瑞德西韋治療冠狀病毒感染的作用進行分析外,還篩選出對冠狀病毒有治療效果的BCX4430,匹莫地韋(VX-787),並列舉了詳實的實驗資料。
圖5. 吉利德科學公司在抗RNA病毒藥物領域的專利狀況
報告針對體外試驗在研藥,從RNA聚合酶抑制劑類藥物篩選出50項重點專利,均記載了體外試驗,其中5項在實驗部分記載了有關CoV活性實驗資料,5項雖然記載了實驗專案但並未公開實驗結果資料,6項記載了體內活性。對於冠狀病毒主蛋白酶或3C樣蛋白酶抑制劑、刺突蛋白酶抑制劑、血管緊張素轉化酶2阻斷抑制劑和囊膜阻斷劑等其他幾類藥物,均公開了體外細胞試驗的結果。
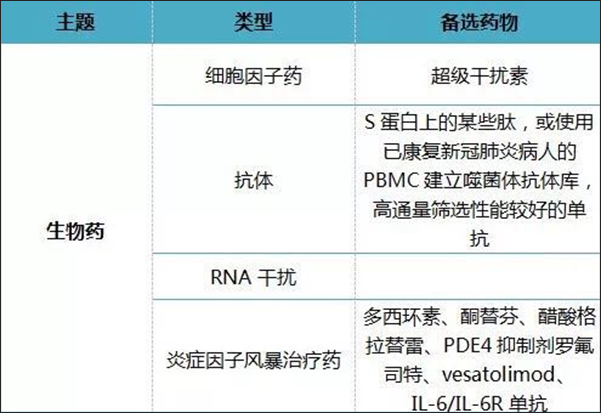
而就生物藥的報分,報告提供了具有潛在價值的專利資訊(詳見圖6)。
圖6. 抗冠狀病毒生物藥技術分解表
冠狀病毒疫苗專利申請總體情況
而在疫苗部分,報告則提出了重點方向,指出應當放在滅活疫苗和核酸疫苗。
依據2003年至今,中國國家藥品監督管理局發佈的獲批冠狀病毒疫苗的物件原理,將疫苗分為5類,包括核酸疫苗、亞單位疫苗、滅活疫苗、減毒疫苗及病毒樣顆粒。從圖7可見,亞單位疫苗之專利申請數量最多,這與當前的病毒疫苗研究熱點相符。此外,由於減毒疫苗對於病毒類型的要求比較高,並不是所有的病毒都適宜於構建減毒疫苗,因此,從專利數量來看相對較少。
圖7. 冠狀病毒疫苗專利申請趨勢
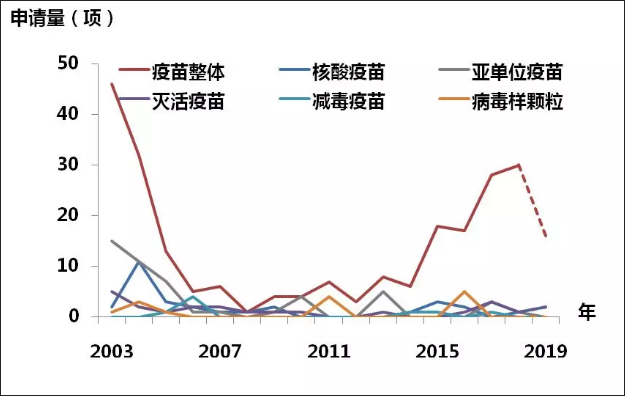
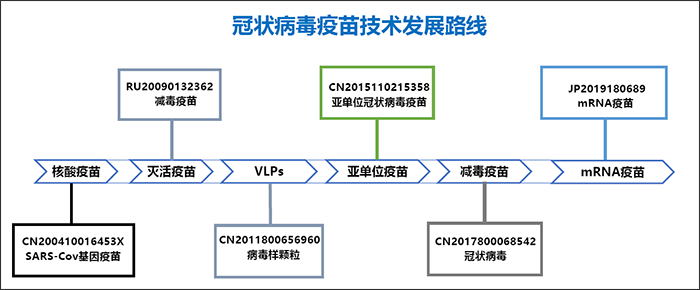
圖8為冠狀病毒疫苗技術發展路線,顯示目前主要重點應當放在滅活疫苗和核酸疫苗相對技術比較成熟的方向,而mRNA疫苗屬於最新技術尚待發展。
圖8. 冠狀病毒疫苗技術發展路線圖
診斷與檢測專利申請分析
從圖9可見,從2003-2019年冠狀病毒檢測和診斷相關專利的整體申請趨勢是先下降後升高。出現SARS疫情和中東呼吸綜合征(MERS)時申請量明顯增長,疫情結束後申請量出現明顯下落。從具體分支的申請量來看,核酸檢測的申請量比蛋白檢測的申請量要高,主要是因為蛋白檢測技術難度高,而且研發的速度也相對較慢。在這次抗擊「新冠肺炎」疫情的過程中,中國藥監局審批通過的7個試劑盒均為核酸檢測試劑盒。
圖9. 診斷與檢測專利申請趨勢
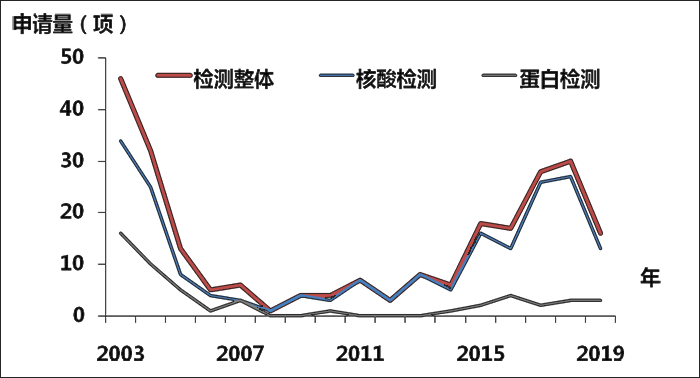
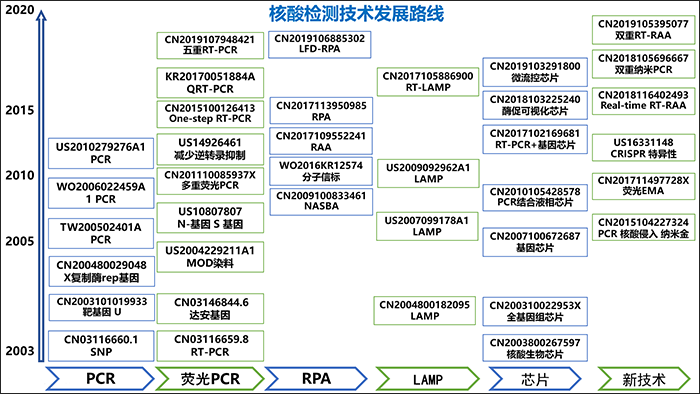
圖10示出為核酸檢測技術發展路線圖,臨床上針對冠狀病毒引發疾病的診斷以核酸檢測為主,核酸檢測方法包括PCR、螢光PCR、RPA、LAMP、基因晶片以及新技術等,其中以PCR為主。
圖 10. 核酸檢測技術發展路線圖
參考資料:《抗擊新型冠狀病毒肺炎專利資訊研報》;中國國家知識產權局抗擊新型冠狀病毒肺炎專利資訊分析課題組,2020年2月 14日
※ 原報告下載
| 作者: |
李淑蓮 |
| 現任: |
北美智權報主編 |
| 學歷: |
文化大學新聞研究所 |
| 經歷: |
半導體科技雜誌(SST-Taiwan)總編輯
CompuTrade International總編輯
日本電波新聞 (Dempa Shinbun) 駐海外記者
日經亞洲電子雜誌 (台灣版) 編輯 |
|
|
|
| Facebook |
|
在北美智權報粉絲團上追踪我們 |
     |
|
|
|
|
|
|
|

